「プロジェクト」の版間の差分
yhlabj>Yasunori Hayashi |
Yasunori Hayashi (トーク | 投稿記録) 細 (1版 をインポートしました) |
(相違点なし)
| |
2023年4月11日 (火) 00:33時点における最新版
タンパク質のシナプス移行と長期増強現象
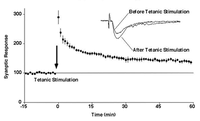
海馬神経細胞に対して強い刺激を行うと、シナプス伝達効率が長期に向上することが知られています。これを長期増強現象(LTP)といい、学習・記憶の細胞レベルの現象ではないかと考えられてきました。しかし、どのようにしてシナプス伝達の効率が長期に向上するのかは明らかになっていませんでした。
私達は、新しいAMPA型グルタミン酸受容体がシナプスへ移行することで、シナプス後部の感受性を向上しているのではないかと考えました。そのため、GFP融合蛋白質あるいは電気生理学的にタギングを行いAMPA受容体を区別できるようにした上で、新たなAMPA受容体がシナプスへ移行することを実証しました [1] [2] [3] 。このプロセスにはCa2+/カルモジュリン依存性タンパク質キナーゼII (CaMKII) とPDZドメインタンパク質との相互作用を必要としました。さらに活動依存性のシナプス移行はAMPA受容体に限ったものではなく、多くの蛋白質に系統的に起こることを示しました [4]。
一方で、このプロセスには一般に考えられてきたのとは異なりAMPA受容体のリン酸化は必要としませんでした[2]。リン酸化されているAMPA受容体の量は非常に僅かなもので、シナプス移行を説明するものではありませんでした[5]。そのため、AMPA受容体のシナプスへの移行の引き金となるメカニズムと一旦移行した受容体をそのシナプスに留めるメカニズムは未だ不明です。
液-液相分離とシナプス可塑性
Ca2+/カルモジュリン依存性蛋白質キナーゼII (CaMKII)はシナプス可塑性に必要なセリン・スレオニンキナーゼとして知られてきています [7] 。CaMKIIはシナプス後肥厚(PSD)画分に他のどのシグナル伝達分子よりも多量に含まれており、殆ど構造タンパク質と同程度の量が存在します[7]。キナーゼは 1分子で、多数の基質蛋白質をリン酸化出来るので、CaMKIIがキナーゼとして働くのだけでしたら、こんなにたくさんある必要はありません。また、CaMKIIは他のキナーゼには見られない12量体構造をとっています。これらは謎として残されてきました。
一方で、私達は低分子GTP結合タンパク質Racを活性化する、Tiam1がCa2+依存的にCaMKIIとして安定した結合を形成することを見出しました[8]。それだけではなく、CaMKIIは多数のタンパク質と結合して、それらをクロスリンクすることに気付きました(未発表)。これらの結果から、CaMKIIは液-液相分離を起こすのではないかという考えに至りました。液-液相分離とは蛋白質の溶液が、水と油のように濃縮相と稀釈相に分離する現象です [9] 。CaMKIIは不活化型の時は分離しませんでしたが、Ca2+で活性化すると液-液相分離を起こし、濃縮相を形成しました。さらにその他の蛋白質の濃縮相への集積も促しました [6]。私達は、このCaMKIIの性質が、LTPに伴って蛋白質がシナプスへ移行、集積する原理ではないかと考えています[10]。
樹状突起スパインの構造的可塑性の分子機構
さらにシナプスの活性化により、シナプス形成の場である樹状突起スパインの拡大も引き起こされます [11] [12] [4](動画)。FRETセンサーを用いることで、これに伴い線維状アクチンが増加することも示しました [13] [14]。重要なことは、この変化は刺激後少なくとも持続したことです。増加したアクチンにより、シナプス構造が拡大するのと同時に、その他のタンパク質の足場として機能していると考えられます。
私達は生化学的実験によりCaMKIIがアクチン線維を束化することができることを見出しました[15]。CaMKIIはLTP誘導に伴い活性化されるとF-アクチンから遊離し、F-アクチンとその制御因子が結合することが出来ます[16]。このことから、CaMKIIは興奮性シナプスで情報伝達分子であるばかりではなく、構造蛋白質しても重要な役割を果たしていると考えています[17][7]。
構造LTP[4]
赤い点が出た時点でグルタミン酸の脱ケージ化でGFPを発現するスパインの先端を刺激している。アクチン重合とスパインの拡大[13]
CaMKIIによる構造LTPのゲート機構[16]
CaMKIIの自己リン酸化により線維状アクチンから離脱し、その修飾が可能となる。
記憶エングラムの動態解析
海馬には動物がある場所にある時にいる特異的に発火する、場所細胞と呼ばれる細胞が存在し、場所に関する記憶をコードしていると考えられています。しかし、場所細胞がどのように形成され、それくらい持続するかはよく判っていませんでした。これを解明するため、仮想現実空間内でマウスを行動させ、海馬から二光子顕微鏡でカルシウム反応を記録する実験を行いました [18] [19] [20] 。カルシウム反応の画像から、自動的に個々の細胞を分離し、スパイクパタンを予測しています [21] 。この実験により記憶エングラム細胞は報酬やランドマークがある所で特異的に安定化されること、また自閉症モデル動物ではそれが障害されることが明らかになりました[20]。
動画. マウス仮想現実空間[19]
引用文献
- ↑ 1.0 1.1
Shi, S.H., Hayashi, Y., Petralia, R.S., Zaman, S.H., Wenthold, R.J., Svoboda, K., & Malinow, R. (1999).
Rapid spine delivery and redistribution of AMPA receptors after synaptic NMDA receptor activation. Science (New York, N.Y.), 284(5421), 1811-6. [PubMed:10364548] [WorldCat] [DOI] [Google Scholar] - ↑ 2.0 2.1
Hayashi, Y., Shi, S.H., Esteban, J.A., Piccini, A., Poncer, J.C., & Malinow, R. (2000).
Driving AMPA receptors into synapses by LTP and CaMKII: requirement for GluR1 and PDZ domain interaction. Science (New York, N.Y.), 287(5461), 2262-7. [PubMed:10731148] [WorldCat] [DOI] [Google Scholar] - ↑
Shi, S., Hayashi, Y., Esteban, J.A., & Malinow, R. (2001).
Subunit-specific rules governing AMPA receptor trafficking to synapses in hippocampal pyramidal neurons. Cell, 105(3), 331-43. [PubMed:11348590] [WorldCat] [DOI] [Google Scholar] - ↑ 4.0 4.1 4.2
Bosch, M., Castro, J., Saneyoshi, T., Matsuno, H., Sur, M., & Hayashi, Y. (2014).
Structural and molecular remodeling of dendritic spine substructures during long-term potentiation. Neuron, 82(2), 444-59. [PubMed:24742465] [PMC] [WorldCat] [DOI] [Google Scholar] - ↑
Hosokawa, T., Mitsushima, D., Kaneko, R., & Hayashi, Y. (2015).
Stoichiometry and phosphoisotypes of hippocampal AMPA-type glutamate receptor phosphorylation. Neuron, 85(1), 60-67. [PubMed:25533481] [PMC] [WorldCat] [DOI] [Google Scholar] - ↑ 6.0 6.1
Hosokawa, T., Liu, P.W., Cai, Q., Ferreira, J.S., Levet, F., Butler, C., Sibarita, J.B., Choquet, D., Groc, L., Hosy, E., Zhang, M., & Hayashi, Y. (2021).
CaMKII activation persistently segregates postsynaptic proteins via liquid phase separation. Nature neuroscience, 24(6), 777-785. [PubMed:33927400] [WorldCat] [DOI] [Google Scholar] - ↑ 7.0 7.1 7.2
Kim, K., Saneyoshi, T., Hosokawa, T., Okamoto, K., & Hayashi, Y. (2016).
Interplay of enzymatic and structural functions of CaMKII in long-term potentiation. Journal of neurochemistry, 139(6), 959-972. [PubMed:27207106] [WorldCat] [DOI] [Google Scholar] - ↑
Saneyoshi, T., Matsuno, H., Suzuki, A., Murakoshi, H., Hedrick, N.G., Agnello, E., O'Connell, R., Stratton, M.M., Yasuda, R., & Hayashi, Y. (2019).
Reciprocal Activation within a Kinase-Effector Complex Underlying Persistence of Structural LTP. Neuron, 102(6), 1199-1210.e6. [PubMed:31078368] [PMC] [WorldCat] [DOI] [Google Scholar] - ↑
Hayashi, Y., Ford, L.K., Fioriti, L., McGurk, L., & Zhang, M. (2021).
Liquid-Liquid Phase Separation in Physiology and Pathophysiology of the Nervous System. The Journal of neuroscience : the official journal of the Society for Neuroscience, 41(5), 834-844. [PubMed:33472825] [PMC] [WorldCat] [DOI] [Google Scholar] - ↑
Liu, P.W., Hosokawa, T., & Hayashi, Y. (2021).
Regulation of synaptic nanodomain by liquid-liquid phase separation: A novel mechanism of synaptic plasticity. Current opinion in neurobiology, 69, 84-92. [PubMed:33752045] [WorldCat] [DOI] [Google Scholar] - ↑
Hayashi, Y., & Majewska, A.K. (2005).
Dendritic spine geometry: functional implication and regulation. Neuron, 46(4), 529-32. [PubMed:15944122] [WorldCat] [DOI] [Google Scholar] - ↑
Bosch, M., & Hayashi, Y. (2012).
Structural plasticity of dendritic spines. Current opinion in neurobiology, 22(3), 383-8. [PubMed:21963169] [PMC] [WorldCat] [DOI] [Google Scholar] - ↑ 13.0 13.1
Okamoto, K., Nagai, T., Miyawaki, A., & Hayashi, Y. (2004).
Rapid and persistent modulation of actin dynamics regulates postsynaptic reorganization underlying bidirectional plasticity. Nature neuroscience, 7(10), 1104-12. [PubMed:15361876] [WorldCat] [DOI] [Google Scholar] - ↑
Okamoto, K., & Hayashi, Y. (2006).
Visualization of F-actin and G-actin equilibrium using fluorescence resonance energy transfer (FRET) in cultured cells and neurons in slices. Nature protocols, 1(2), 911-9. [PubMed:17406324] [WorldCat] [DOI] [Google Scholar] - ↑
Okamoto, K., Narayanan, R., Lee, S.H., Murata, K., & Hayashi, Y. (2007).
The role of CaMKII as an F-actin-bundling protein crucial for maintenance of dendritic spine structure. Proceedings of the National Academy of Sciences of the United States of America, 104(15), 6418-23. [PubMed:17404223] [PMC] [WorldCat] [DOI] [Google Scholar] - ↑ 16.0 16.1
Kim, K., Lakhanpal, G., Lu, H.E., Khan, M., Suzuki, A., Hayashi, M.K., Narayanan, R., Luyben, T.T., Matsuda, T., Nagai, T., Blanpied, T.A., Hayashi, Y., & Okamoto, K. (2015).
A Temporary Gating of Actin Remodeling during Synaptic Plasticity Consists of the Interplay between the Kinase and Structural Functions of CaMKII. Neuron, 87(4), 813-26. [PubMed:26291163] [PMC] [WorldCat] [DOI] [Google Scholar] - ↑
Okamoto, K., Bosch, M., & Hayashi, Y. (2009).
The roles of CaMKII and F-actin in the structural plasticity of dendritic spines: a potential molecular identity of a synaptic tag? Physiology (Bethesda, Md.), 24, 357-66. [PubMed:19996366] [WorldCat] [DOI] [Google Scholar] - ↑
Sato, M., Kawano, M., Ohkura, M., Gengyo-Ando, K., Nakai, J., & Hayashi, Y. (2015).
Generation and Imaging of Transgenic Mice that Express G-CaMP7 under a Tetracycline Response Element. PloS one, 10(5), e0125354. [PubMed:25946002] [PMC] [WorldCat] [DOI] [Google Scholar] - ↑ 19.0 19.1
Sato, M., Kawano, M., Mizuta, K., Islam, T., Lee, M.G., & Hayashi, Y. (2017).
Hippocampus-Dependent Goal Localization by Head-Fixed Mice in Virtual Reality. eNeuro, 4(3). [PubMed:28484738] [PMC] [WorldCat] [DOI] [Google Scholar] - ↑ 20.0 20.1
Sato, M., Mizuta, K., Islam, T., Kawano, M., Sekine, Y., Takekawa, T., Gomez-Dominguez, D., Schmidt, A., Wolf, F., Kim, K., Yamakawa, H., Ohkura, M., Lee, M.G., Fukai, T., Nakai, J., & Hayashi, Y. (2020).
Distinct Mechanisms of Over-Representation of Landmarks and Rewards in the Hippocampus. Cell reports, 32(1), 107864. [PubMed:32640229] [PMC] [WorldCat] [DOI] [Google Scholar] - ↑ Takekawa, T., Asai, H., Ohkawa, N., Nomoto, M., Okubo-Suzuki, R., Ghandour, K., Sato, M., Hayashi, Y., Inokuchi, K., Fukai, T.
Automatic sorting system for large calcium imaging data
bioRxiv, 2017 [DOI] [Google Scholar]

![アクチン重合とスパインの拡大[13]](http://glutamate.med.kyoto-u.ac.jp/shared/images/thumb/5/55/Actin-polyemerization.jpg/200px-Actin-polyemerization.jpg)
![CaMKIIによる構造LTPのゲート機構[16] CaMKIIの自己リン酸化により線維状アクチンから離脱し、その修飾が可能となる。](http://glutamate.med.kyoto-u.ac.jp/shared/images/thumb/2/25/Gating_of_sLTP_by_CaMKII.jpg/200px-Gating_of_sLTP_by_CaMKII.jpg)