記憶の持続メカニズムを解明
概要
私たちは、一瞬にしか過ぎない出来事を、長期間に亘って記憶することが出来ます。そのため、脳には一瞬の情報を長期的な情報として蓄えるメカニズムがあると考えられてきました。しかし、その分子の実態は、よく分かっていませんでした。我々は、ある2つの分子が結合した時にだけ、2つの分子活性が長期に保たれることに気づきました。普通は一方の分子がもう1つの分子を一方向性に活性化します。ところが面白いことに、我々が見つけた分子複合体では、逆方向の活性化も引き起こしました。つまり一度分子が結合すると、2つの分子がお互いを活性化し合うことで、その活性を長期に亘り継続することが判りました。
このメカニズムによって、2つの神経細胞同士のシナプス伝達が強くなり、それが長く継続しました。これは長期増強現象(LTP)と呼ばれ、学習記憶の細胞でのモデルとして広く受け入れられていますが、一過的な刺激を長期にわたるシナプス機能の増強へと変換する仕組みは分かっていませんでした。我々が発見した原理は、シナプス機能の増強を維持する記憶のメカニズムであると考えられます。
本研究成果は、實吉岳郎准教授を筆頭著者とし、2019 年5月 9 日に米国の国際学術誌「Neuron」にオンライン掲載されました[1]。
背景
私たちは過去の出来事や体験を、あるものは詳細に、あるものはぼんやりと覚えています。脳には過去の記憶を何らかの形で貯蔵する仕組みが備わっています。この仕組みのひとつは、記憶される出来事に反応して神経細胞間の連絡が変化し、神経細胞同士の繋がり方、すなわち神経回路網に記憶が貯蔵されるものです。この神経細胞回路の接続部であるシナプスは、刺激の大きさや頻度によって性質や形が変化し、それを持続することが知られていますシナプス可塑性)。個々のシナプスの性質の変化は、神経回路網に保存される記憶の素子であり、その集積によって情報として蓄えられていると考えられています。
シナプス可塑性の中でも長期増強現象(LTP)は、グルタミン酸受容体からシナプスへCa2+が流入し、カルシウムカルモデュリン依存性タンパク質リン酸化酵素2 (CaMKII)の活性化をへて最終的に長期にわたるシナプス伝達強度を増強します[2]。LTPでみられるシナプス強度の持続は、細胞レベルでの記憶の基礎であると考えられています。
LTP刺激を受けると、シナプスではカルシウムイオン濃度がミリ秒単位で上昇し、続くCaMKIIは1分間程度活性化します[3][4] 。これに対してシナプスの形を支えるスパイン樹状突起上に形成される小突起)内のアクチン細胞骨格の活性化は30分間以上持続します[5]。しかし、非常に短いカルシウムイオン濃度の上昇をどのように長期間持続するシナプス伝達強度へと変換するのかは、全く解っていませんでした。
實吉岳郎准教授らを中心とした我々のグループは、CaMKIIとアクチン細胞骨格に着目して、長らく未解明だった、シナプス可塑性における一過的なカルシウムシグナルを持続する生化学反応へ変換するメカニズムの解明を試みました。
研究手法・成果
本研究は、ラット海馬興奮性神経細胞をモデルにLTP刺激により起こる生化学的な変化をライブイメージング、生化学、分子生物学的手法を組み合わせて行いました。
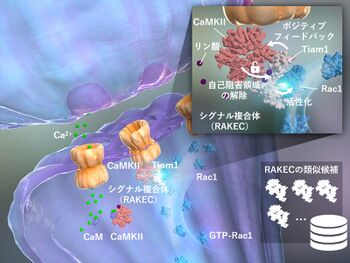
これまでの研究からアクチン重合へ至るコフィリンアクチン線維の脱重合を促進するタンパク質)を介した情報伝達経路、特にRho経路Rhoは細胞骨格を制御する低分子量Gタンパク質ファミリーのひとつ)が重要であることが分かっていました[6] 。そこで、LTP発現時にRho経路の一つであるRac1の活性化様式を詳細に調べると、刺激をうけたスパインではRac1の活性化は、LTP刺激がなくても続いていることがわかりました。また、Rac1を活性化するタンパク質の中でCaMKIIと結合するものを調べたところ、Tiam1が安定して結合することがわかりました[1]。
さらに、結合様式を生化学的に検討したところ、Tiam1とCaMKIIの結合には、
- カルシウムカルモデュリンが必要なこと
- 一度結合が成立するとカルシウムカルモデュリンは必要なくなること
- CaMKIIの酵素活性は必要ないこと
- CaMKIIはTiam1の1543-1557に結合すること
- Tiam1は、CaMKIIのT-siteに結合すること
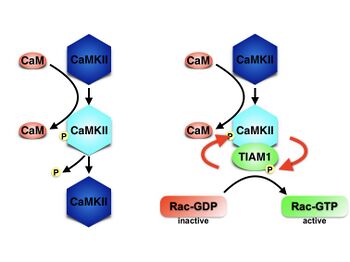
がわかりました。さらにこの複合体では、Tiam1はCaMKIIによってリン酸化され、活性化すること、CaMKIIはTiam1との結合によって自己リン酸化とは独立したカルシウム非依存的酵素活性を獲得することがわかりました。つまり、Tiam1とCaMKIIはお互いを活性化し合う酵素と基質のシグナル複合体であることが明らかになりました。我々は、このような複合体をRAKEC (reciprocally activating kinase-effector complex)と名付けました[1]。
LTP誘導に際して、スパイン内でのRAKECの挙動をFRETライブイメージングの手法で検討すると、神経伝達物質であるグルタミン酸刺激により急速にTiam1/CaMKII複合体が形成され、30分間以上持続していました。また、分子置換法による検討で、Tiam1/CaMKII複合体はRac1活性化およびシナプス構造可塑性に必須である事がわりました[1]。
以上のことから、シナプス可塑性においてシナプス単位の記憶が、Tiam1とCaMKIIからなるRAKECとして形成、維持されるメカニズムを明らかにしました。本研究成果は、これまで特定の分子のリン酸化や発現量などでは説明つかなかった分子記憶が、タンパク質間相互作用として存在するという新しいコンセプトを提案するものです。
波及効果、今後の予定
本研究により分子記憶の一つがタンパク質間相互作用として存在する事を示しました。CaMKIIは、Rac1活性化だけではなく、様々な情報伝達経路に関わっていることが知られているので、今回のTiam1とのRAKECのみならず多くの分子との相互作用が予想されます。CaMKIIがシナプスで非常に高い濃度で存在することは、CaMKIIが維持する情報の多くがRAKECを形成する分子間相互作用によるものである事を示唆します。今後、発見されたタンパク質間相互作用としての分子記憶の個体レベルで記憶への関与、他のRAKECの存在や機能について、など研究を進めていきたいと考えています。
研究プロジェクトについて
本研究は、自然科学研究機構生理学研究所 村越秀治准教授、Massachusetts大学 Margaret Stratton助教授、マックスプランクフロリダ神経科学研究所 安田涼平ディレクターとの共同研究として行われました。
また、本研究は理化学研究所、理化学研究所理事長ファンド、米国国立衛生研究所NIH研究プロジェクト助成プログラム (R01-DA17310, DP1-NS096787, R01-MH080047)、文部科学省科学研究費補助金 (基盤研究(A): 20240032、16H02455; 基盤研究(B): 18H02528; 若手研究(A): 24680036; 新学術領域研究:シナプスニューロサーキットパソロジーの創成: 22110006, 共鳴誘導で革新するバイオイメージング: 18H04733, マルチスケール精神病態の構成的理解: 18H05434; 細胞機能と分子活性の多次元蛍光生体イメージング: 25113726、23113522)、ヒューマンフロンティアサイエンスプログラム、公益財団法人 上原記念生命科学財団、公益財団法人 内藤記念科学振興財団、公益財団法人 武田科学振興財団、公益財団法人 日本応用酵素協会、公益財団法人 ノバルティス科学振興財団、公益財団法人 光科学技術研究振興財団、公益財団法人 ブレインサイエンス振興財団、Guangdong Key International Visiting Program、公益財団法人 京都大学教育振興財団、公益財団法人 島津科学技術振興財団、公益財団法人 薬理研究会の支援を受けて行われました。
この場を借り、共同研究者の先生方ならびに研究費の支援を下さった方々に篤く御礼を申し上げます。
参考文献
- ↑ 1.0 1.1 1.2 1.3
Saneyoshi, T., Matsuno, H., Suzuki, A., Murakoshi, H., Hedrick, N.G., Agnello, E., O'Connell, R., Stratton, M.M., Yasuda, R., & Hayashi, Y. (2019).
Reciprocal Activation within a Kinase-Effector Complex Underlying Persistence of Structural LTP. Neuron, 102(6), 1199-1210.e6. [PubMed:31078368] [PMC] [WorldCat] [DOI] - ↑
Saneyoshi, T., & Hayashi, Y. (2012).
The Ca2+ and Rho GTPase signaling pathways underlying activity-dependent actin remodeling at dendritic spines. Cytoskeleton (Hoboken, N.J.), 69(8), 545-54. [PubMed:22566410] [WorldCat] [DOI] - ↑
Takao, K., Okamoto, K., Nakagawa, T., Neve, R.L., Nagai, T., Miyawaki, A., Hashikawa, T., Kobayashi, S., & Hayashi, Y. (2005).
Visualization of synaptic Ca2+ /calmodulin-dependent protein kinase II activity in living neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(12), 3107-12. [PubMed:15788767] [PMC] [WorldCat] [DOI] - ↑
Lee, S.J., Escobedo-Lozoya, Y., Szatmari, E.M., & Yasuda, R. (2009).
Activation of CaMKII in single dendritic spines during long-term potentiation. Nature, 458(7236), 299-304. [PubMed:19295602] [PMC] [WorldCat] [DOI] - ↑
Okamoto, K., Nagai, T., Miyawaki, A., & Hayashi, Y. (2004).
Rapid and persistent modulation of actin dynamics regulates postsynaptic reorganization underlying bidirectional plasticity. Nature neuroscience, 7(10), 1104-12. [PubMed:15361876] [WorldCat] [DOI] - ↑
Bosch, M., Castro, J., Saneyoshi, T., Matsuno, H., Sur, M., & Hayashi, Y. (2014).
Structural and molecular remodeling of dendritic spine substructures during long-term potentiation. Neuron, 82(2), 444-59. [PubMed:24742465] [PMC] [WorldCat] [DOI]