脳内地図を細胞レベルで観察 -自閉症関連遺伝子Shank2はランドマーク情報に必須-
背景
動物にとって場所の記憶と目的地にたどり着く行動(ナビゲーション)は、餌や繁殖相手を探し、巣に戻って危険から身を守るなど、個体の生存と種の存続のために必須の行動です。哺乳類の海馬には、いわば自分自身の位置を知るGPSのように、ある特定の場所を通るときにだけ活動する「場所細胞」が存在します。そして、「いつ、どこで、何が起こったか」といった出来事の記憶を海馬に貯蔵するためには、場所の情報だけではなく、そこにどんな特徴が存在したかなどの場所以外の情報を、多数の場所細胞によって構成される「認知地図」上に記録する必要があります。
以前から、動物が新しい環境を探索すると、新しい場所細胞が海馬で直ちに形成されることが知られていました。しかし、海馬の認知地図がどのような細胞レベルの活動の変化で形成され、学習経験に伴って精緻化するのかについてはよく分かっていませんでした。また、自閉スペクトラム症など自分を取り巻く環境の知覚や認知に特有の傾向を示す脳疾患において、海馬の認知地図にどのような変化が起こっているのかについても理解が進んでいませんでした。
研究手法と成果
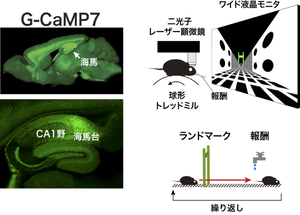
国際共同研究グループは2017年、マウスのバーチャル空間の認識には海馬の活動が必要なこと、およびその目的地の学習にはShank2遺伝子が必要であることを明らかにしました(注1)。今回の研究では、このとき同グループが開発したマウス用バーチャルリアリティシステムに二光子レーザー顕微鏡を組み合わせ、海馬のCA1野と呼ばれる領域に、空間学習に伴って認知地図が形成される過程を観察しました。
細胞の活動を画像化するために、高反応性蛍光カルシウムセンサータンパク質G-CaMP7を海馬に発現する遺伝子改変マウスを作製しました(図1)。このG-CaMP7は、オワンクラゲ由来の緑色蛍光タンパク質(GFP)を人工的に改変したタンパク質であり、神経細胞の活動によって細胞内で増加するカルシウムイオンに結合すると、強い緑色の蛍光を発して細胞を「光らせ」ます。この遺伝子改変マウスにより、海馬CA1野の約0.5mm四方に存在する数百個の神経細胞の活動を二光子レーザー顕微鏡で均一に観察することが可能になりました。
バーチャル空間には、空間学習の課題として⻑い廊下のような直線路を設定しました。この直線路の一点にランドマークとして緑色のゲートを置き、別の場所に通過すると報酬として水が得られる報酬地点を設定しました。マウスにはこの直線路を1回10分間のセッションで、1日1、2セッションずつ合計15セッション走らせました。そして1-5セッション目を初期、6-10セッション目を中期、11-15セッション目を後期として解析しました。
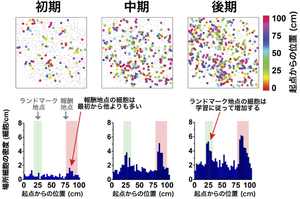
まず、海馬の認知地図の形成過程を明らかにするために、訓練の最初のセッションから画像化しました。マウスは、訓練を繰り返すにつれて直線路を走る時間が増え、訓練の後期には、報酬地点が近づくと、その手前で走るスピードを減速したり、報酬の出るチューブをなめ始めたりするなど、報酬の受け取りを期待する行動が見られるようになりました。このように学習が進むに従って、画像では場所細胞の数が全体的に増えていく様子が観察されました(図2上段)。
また、報酬地点で応答する場所細胞の割合は、他の場所で応答する場所細胞と比較して、最初のセッションの段階から増加したのに対し、ランドマーク地点で応答する場所細胞の割合は、学習が進むに従って徐々に増加しました(図2下段)。このことは、他の場所と比べた相対的な場所細胞の増加が海馬の認知地図において行動上重要な特徴の存在を示す情報であること、およびモチベーションに関わる「報酬」と視覚的手掛かりである「ランドマーク」という別々の種類の特徴は、異なる時間的変化で場所細胞を増加させることを示しています。
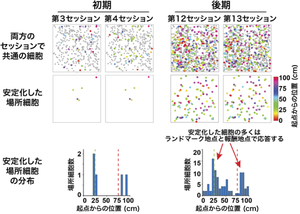
この海馬の認知地図は、同じマウスから得られたものであっても、一見すると個々のセッション間でずいぶんと異なっていました。そこで、同じ課題を繰り返し学習することで獲得される場所の情報が、どのように海馬の認知地図に記録されているのかを調べるために、連続するセッションの認知地図の画像から同一の場所細胞を探し出し、それらの細胞がどの場所で応答したかを比較しました。すると、同じ場所で応答する「安定化した」場所細胞が、学習が進むに従って増えること、またこれらの安定化した場所細胞の大部分は、ランドマーク地点や報酬地点で応答する細胞であることが分かりました(図3)。これは、行動上重要な特徴を持つ場所の脳内表現は、そうでない場所よりも安定に保持されることを示しています。
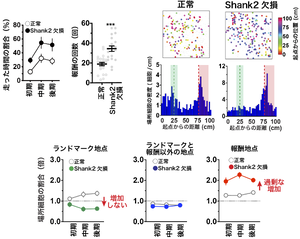
最後に、この海馬の認知地図が自閉スペクトラム症のモデルマウスの一つであるShank2欠損マウスでどのように変化しているかを調べました。Shank2欠損マウスは、社会行動の異常や反復行動など、ヒトの自閉スペクトラム症に似た行動を示します。Shank2欠損マウスは正常マウスに比べて、直線路を走る時間が多く、報酬もより多く獲得しました(図4)。また、報酬地点直前の走るスピードの減速も大きかったことから、このマウスは単なる多動ではなく、むしろゴールを目指す行動が亢進していると考えられました。興味深いことに、Shank2欠損マウスの海馬の認知地図を画像化すると、ランドマーク地点で応答する場所細胞の割合は増加せず、報酬地点で応答する場所細胞の割合は正常マウスよりも過剰に増加していました(図4)。すなわち、ランドマーク地点で応答する場所細胞の増加にはShank2遺伝子が必須であるが、報酬地点で応答する場所細胞の増加には必須ではないことから、二つの場所細胞の増加は異なるメカニズムで起こることが明らかになりました。
今後の期待
本研究により、場所細胞の相対的な増加はその場所における顕著な特徴の情報を担っており、場所細胞の安定化というメカニズムで起こることが明らかになりました。さらに、自閉スペクトラム症マウスモデルを用いた実験により、報酬とランドマークという二つの異なる種類の特徴の情報は、海馬の認知地図において、別々のメカニズムと細胞集団によって表現されていることが分かりました。
自閉スペクトラム症患者のナビゲーション行動を調べた研究は、現在のところあまり多くありませんが、マウスモデルを用いた本研究の結果が、今後この研究の進展を促すかもしれません。自閉スペクトラム症患者は、一般に細かい視覚的認知能力に⻑けているといわれるなど、彼らを取り巻く世界の知覚や認知には特有の傾向が見られますが、その詳細な脳内機構には不明な点が多く残されています。その症例の一部には、今回の研究が明らかにしたような細胞レベルでの脳内情報表現の異常が関与している可能性が考えられます。
今回の研究で用いたバーチャルリアリティシステムは、被験動物の実験環境を柔軟かつ精密に操作することで、多様な行動課題を行うことが可能です。また、二光子レーザー顕微鏡を用いた脳活動の画像化は、生きた脳の働きを高解像度で「見て」理解することのできる極めて強力な研究手法です。今後、これらを組み合わせた同様の手法をアルツハイマー型認知症などの他の脳疾患モデルマウスを用いた研究に適用することで、幅広い脳疾患の病態解明に貢献することが期待できます。
国際共同研究グループ
理化学研究所 脳神経科学研究センター
- 神経回路・行動生理学研究チーム
- 客員研究員 佐藤 正晃 (さとう まさあき)(北海道大学大学院医学研究院講師、研究当時:脳科学総合研究センター記憶メカニズム研究チーム客員研究員、科学技術振興機構(JST)さきがけ研究者)
- 記憶メカニズム研究チーム(研究当時)
- 基礎科学特別研究員 水田 恒太郎(みずた こうたろう) (京都大学医学系研究科システム神経薬理学 助教)
- 研究員 カラム・キム(Karam Kim)
- テクニカルスタッフ タンビル・イスラム(Tanvir Islam)
- テクニカルスタッフ 関根 友紀子(せきね ゆきこ)
- テクニカルスタッフ 河野 真子 (かわの まさこ)
- 脳回路機能理論研究チーム(研究当時)
- チームリーダー 深井 朋樹 (ふかい ともき) (沖縄科学技術大学院大学 教授)
- 研究員 竹川 高志 (たけかわ たかし) (工学院大学情報学部 准教授)
理化学研究所 生命機能科学研究センター
- バイオコンピューティング研究チーム
- 客員主管研究員 山川 宏 (やまかわ ひろし) (東京大学大学院工学系研究科 特任研究員、特定非営利活動法人全脳アーキテクチャ・イニシアチブ 代表)
京都大学大学院
- 医学研究科システム神経薬理学分野
- 教授 林 康紀 (はやし やすのり)(現職)(元 理化学研究所 脳科学総合研究センター シニア・チームリーダー、元 埼玉大学脳末梢科学研究センター 連携教授)
埼玉大学大学院
- 理工学研究科/埼玉大学脳末梢科学研究センター
- 教授 中井 淳一(なかい じゅんいち) (東北大学大学院⻭学研究科 教授)(研究当時)
- 准教授 大倉 正道(おおくら まさみち) (九州保健福祉大学薬学部 教授)
韓国 延世(ヨンセ)大学
- 医学部 薬理学講座
- 教授 ミン・グー・リー(Min Goo Lee)
スペイン カハール研究所
- 大学院生 ダニエル・ゴメスードミンゲス(Daniel Gomez-Dominguez)
ドイツ マックス・プランク研究所
- 教授 フレッド・ウォルフ(Fred Wolf)
- 大学院生 アレキサンダー・シュミット(Alexander Schmidt)
研究支援
本研究は、科学技術振興機構(JST)さきがけ「細胞機能の構成的な理解と制御」領域 の研究課題「脳内情報を担う動的回路としての「細胞集成体」の計測と制御(研究代表 者:佐藤正晃)」として実施されたものであり、文部科学省科学研究費補助金新学術領域 研究「マイクロエンドフェノタイプによる精神病態学の創出」「多様性から明らかにする 記憶ダイナミズムの共通原理」「生物ナビゲーションのシステム科学」「脳タンパク質老 化と認知症制御」「シナプス・ニューロサーキットパソロジーの創成」「マルチスケール 精神病態の構成的理解」およびヒューマン・フロンティア・サイエンス・プログラムなど の支援を受けて行われました。
参考文献
-
Sato, M., Mizuta, K., Islam, T., Kawano, M., Sekine, Y., Takekawa, T., Gomez-Dominguez, D., Schmidt, A., Wolf, F., Kim, K., Yamakawa, H., Ohkura, M., Lee, M.G., Fukai, T., Nakai, J., & Hayashi, Y. (2020).
Distinct Mechanisms of Over-Representation of Landmarks and Rewards in the Hippocampus. Cell reports, 32(1), 107864. [PubMed:32640229] [PMC] [WorldCat] [DOI]